Research
- Research Topics
- Cell Biology and Tumor Biology
- Stem Cells and Cancer
- Inflammatory Stress in Stem Cells
- Experimental Hematology
- Molecular Embryology
- Signal Transduction and Growth Control
- Epigenetics
- Redox Regulation
- Vascular Oncology and Metastasis
- Clinical Neurobiology
- Molecular Neurogenetics
- Vascular Signaling and Cancer
- Molecular Neurobiology
- Mechanisms Regulating Gene Expression
- Molecular Biology of Centrosomes and Cilia
- Dermato-Oncology
- Pediatric Leukemia
- Tumour Metabolism and Microenvironment
- Personalized Medical Oncology
- Molecular Hematology - Oncology
- Cancer Progression and Metastasis
- Translational Surgical Oncology
- Neuronal Signaling and Morphogenesis
- Cell Signaling and Metabolism
- Cell Fate Engineering and Disease Modeling
- Cancer Drug Development
- Cell Morphogenesis and Signal Transduction
- Functional and Structural Genomics
- Molecular Genome Analysis
- Molecular Genetics
- Pediatric Neurooncology
- Cancer Genome Research
- Chromatin Networks
- Functional Genome Analysis
- Theoretical Systems Biology
- Neuroblastoma Genomics
- Signaling and Functional Genomics
- Signal Transduction in Cancer and Metabolism
- RNA-Protein Complexes and Cell Proliferation
- Systems Biology of Signal Transduction
- Areas of Interest
- Advancement of clinical proteomics for systems medicine
- Bridging from the single cell to the cell population – Epo-induced cellular responses and erythroleukemia
- Deciphering tumor microenvironment interactions determining lung cancer development
- Mechanisms controlling the compensation of liver injury and towards model-based biomarkers for early detection of liver cancer
- Application of dynamic pathway modelling for personalized medicine
- Group Members
- Publications
- Open Positions
- Funding
- Teaching
- Areas of Interest
- Molecular thoracic Oncology
- Proteomics of Stem Cells and Cancer
- Computational Genomics and System Genetics
- Applied Functional Genomics
- Applied Bioinformatics
- Translational Medical Oncology
- Metabolic crosstalk in cancer
- Pediatric Glioma Research
- Cancer Epigenomics
- Translational Pediatric Sarcoma Research
- Artificial Intelligence in Oncology
- Mechanisms of Genomic Variation and Data Science
- Neuropathology
- Pediatric Oncology
- Neurooncology
- Somatic Evolution and Early Detection
- Translational Control and Metabolism
- Soft-Tissue Sarcoma
- Precision Sarcoma Research
- Brain Mosaicism and Tumorigenesis
- Mechanisms of Genome Control
- Translational Gastrointestinal Oncology and Preclinical Models
- Translational Lymphoma Research
- Mechanisms of Leukemogenesis
- Genome Instability in Tumors
- Developmental Origins of Pediatric Cancer
- Brain Tumor Translational Targets
- Translational Functional Cancer Genomics
- Regulatory Genomics and Cancer Evolution
- SPRINT
- Cancer Risk Factors and Prevention
- Cancer Epidemiology
- Biostatistics
- Clinical Epidemiology and Aging Research
- Health Economics
- Physical Activity, Prevention and Cancer
- Preventive Oncology
- Personalized Early Detection of Prostate Cancer
- Digital Biomarkers for Oncology
- Tumorigenesis and molecular cancer prevention
- Genomic Epidemiology
- Cancer Survivorship
- Immunology and Cancer
- Cellular Immunology
- Molecular Oncology of Gastrointestinal Tumors
- Immunoproteomics
- Personalized Immunotherapy
- mRNA Cancer Immunotherapies
- Translational Immunotherapy
- B Cell Immunology
- Immune Diversity
- Structural Biology of Infection and Immunity
- Applied Tumor Immunity
- Neuroimmunology and Brain Tumor Immunology
- Adaptive Immunity and Lymphoma
- Dermal Oncoimmunology
- Immune Regulation in Cancer
- Systems Immunology and Single Cell Biology
- GMP & T Cell Therapy
- Immune Monitoring
- News
- Imaging and Radiooncology
- Radiology
- Research
- Computational Radiology Research Group
- Contrast Agents In Radiology Research Group
- Neuro-Oncologic Imaging Research Group
- Radiological Early Response Assessment Of Modern Cancer Therapies
- Imaging In Monoclonal Plasma Cell Disorders
- 7 Tesla MRI - Novel Imaging Biomarkers
- Functional Imaging
- Visualization And Forensic Imaging
- PET/MRI
- Dual- and Multienergy CT
- Radiomics Research Group
- Prostate Research Group
- Breast Imaging Research Group
- Bone marrow
- Musculoskeletal Imaging
- Microstructural Imaging Research Group
- Staff
- Patients
- Research
- Medical Physics in Radiology
- X-Ray Imaging and Computed Tomography
- Federated Information Systems
- Translational Molecular Imaging
- Medical Physics in Radiation Oncology
- Biomedical Physics in Radiation Oncology
- Intelligent Medical Systems
- Medical Image Computing
- Radiooncology - Radiobiology
- Smart Technologies for Tumor Therapy
- Radiation Oncology
- Molecular Radiooncology
- Nuclear Medicine
- Translational Radiation Oncology
- Molecular Biology of Systemic Radiotherapy
- Interactive Machine Learning
- Intelligent Systems and Robotics in Urology
- Multiparametric methods for early detection of prostate cancer
- Translational Molecular Imaging in Oncologic Therapy Monitoring
- Radiology
- Infection, Inflammation and Cancer
- Tumor Virology
- Pathogenesis of Virus-Associated Tumors
- Immunotherapy and Immunoprevention
- Applied Tumor Biology
- Virotherapy
- Virus-associated Carcinogenesis
- Chronic Inflammation and Cancer
- Microbiome and Cancer
- Experimental Hepatology, Inflammation and Cancer
- Infections and Cancer Epidemiology
- Tumorvirus-specific Vaccination Strategies
- Mammalian Cell Cycle Control Mechanisms
- Molecular Therapy of Virus-Associated Cancers
- DNA Vectors
- Episomal-Persistent DNA in Cancer- and Chronic Diseases
- Cell Biology and Tumor Biology
- Research Groups A-Z
- Junior Research Groups
- Core Facilities
- Data Science @ DKFZ
- INFORM
- Baden-Württemberg Cancer Registry
- Cooperations & Networks
- National Cooperations
- International Cooperations
- Cooperational Research Program with Israel: DKFZ - MOST in Cancer Research
- Program
- Members of the Program Committee
- Call
- Publication Database
- German-Israeli Cancer Research Schools
- Archive
- Heidelberg - Israel, Science and Culture
- Symposium 40 Years of German-Israeli Cooperation
- 35th Anniversary Symposium
- 34th Meeting of the DKFZ-MOST Program
- 40th Anniversary Publication
- 30th Anniversary Publication
- 20th Anniversary Publication
- Flyer - The Cancer Cooperation Program
- List Publications 1976-2004
- Highlight-Projects
- Cooperational Research Program with Israel: DKFZ - MOST in Cancer Research
- Cooperations with industrial companies
- DKFZ PostDoc Network
- Cross Program Topic RNA@DKFZ
- Cross Program Topic Epigenetics@dkfz
- Cross Program Topic Single Cell Sequencing
- WHO Collaborating Centers
- DKFZ Site Dresden
- Health + Life Science Alliance Heidelberg Mannheim
Antigen-loaded antibodies
Project leader:
Acute myeloid leukemia (AML) accounts for 80% of acute leukemia cases in adults and results from the accumulation of immature malignant myeloid cells at the expense of healthy differentiated counterparts. The treatment options for AML remain limited. While a moderate therapy success has been observed in patients below the age of 65, about 70% of older patients succumb to the disease within one year after diagnosis. Therefore, the search for more therapeutic options in AML is imperative.
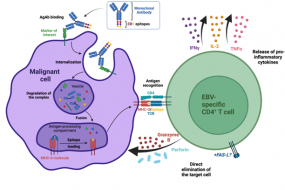
Our laboratory has developed a platform for efficient delivery of immunodominant viral epitopes to tumor cells. The approach is based on antigen-armed antibodies (AgAbs) that carry antigens from the Epstein-Barr virus (EBV). With the help of this strategy, malignant cells become visible for the immune system and are targeted by EBV-specific CD4+ cytotoxic T cells. Indeed, AgAbs bind to surface molecules expressed by the malignant cells and provoke receptor-mediated endocytosis. As a result, viral peptides included in the AgAbs are shuttled into the endosomal compartments of the target cells, where the epitopes can be processed for MHC class II-restricted presentation on the cell surface. In EBV-positive individuals, circulating memory virus-specific cytotoxic CD4+ T cells recognize the MHCII-bound peptides on the surface of tumor cells and mediate cell lysis.
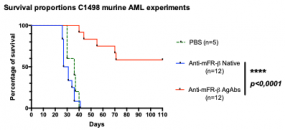
We have developed AgAbs that specifically target AML and leukemia stem cells. This approach makes sense because a high percentage of AML cells express functional MHC-II molecules and up-regulate several specific membrane receptors. Our preliminary experiments suggest that the AgAb strategy in AML is promising. Indeed, AgAbs can eliminate primary AML cells in vitro and ex vivo. Moreover, this therapeutic approach conferred a strong survival advantage in a murine AML model.
Figure 1: Therapeutic rationale for antigen-armed antibodies. AgAbs target markers at the surface of malignant cells. This results in the processing of the conjugated EBV-epitopes and their presentation at the cell surface, on MHC-II molecules. MHCII/peptide complexes are recognized by EBV specific CD4+ T cells, which release pro-inflammatory mediators as well as cytotoxic molecules.
Figure 2: Antigen-armed antibodies can significantly extend the survival of AML-bearing mice. Anti-mouse FR-beta antibodies fused to mCMV epitopes, or their native counterparts, were injected in mCMV+ AML-bearing animals. While no therapeutic benefit was noted for the mice treated with native antibodies, AgAbs significantly improved the outcome in tumor-bearing animals, 7/12 mice surviving until the end of the monitoring period.